网友您好, 请在下方输入框内输入要搜索的题目:
题目内容
(请给出正确答案)
将MnO2和浓盐酸共热时,有73 g氯化氢被氧化,生成氯气的体积(标准状况下)是( )
A.6 L
B.12 L
C.24 L
D.48 L
B.12 L
C.24 L
D.48 L
参考答案
参考解析
解析:根据反应方程式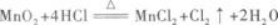
可知参加反应的HCl是4 mol,但被氧化的HCl,即其中氯元素的化合价从-1价变为0价的HCl却是2 mol.这一点很重要.
由此,得到被氧化的HCl与生成Cl2的关系式:
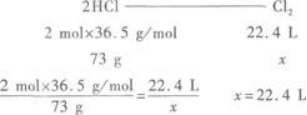
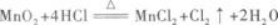
可知参加反应的HCl是4 mol,但被氧化的HCl,即其中氯元素的化合价从-1价变为0价的HCl却是2 mol.这一点很重要.
由此,得到被氧化的HCl与生成Cl2的关系式:
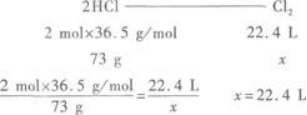
更多 “将MnO2和浓盐酸共热时,有73 g氯化氢被氧化,生成氯气的体积(标准状况下)是( )A.6 L B.12 L C.24 L D.48 L” 相关考题
考题
已知,从φΘ看MnO2不能氧化Cl- ,但将浓盐酸加入MnO2时,可生成Cl2。对其原因下列中啷项说明是正确的?
A. Cl-浓度增加,使φCl2/Cl减少,H+浓度增加,使φMnO2/Mn2+增加
B.两个φΘ相差不大
C.酸性增加,使φMnO2/Mn2+减小
D.以上三个因素都有
考题
设NA为阿伏加德罗常数,下列说法正确的是()。A、标准状况下,5.6L四氯化碳含有的分子数为0.25NAB、标准状况下,14g氮气含有的核外电子数为5NAC、标准状况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数均为NAD、标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
考题
金属M溶于稀盐酸时生成MCl2,其磁矩为5.0B.M.在无氧操作条件下,MCl2溶液遇NaOH溶液生成一白色沉淀A。A接触空气,就逐渐变绿,最后变成棕色沉淀B。灼烧时B生成了棕红色粉末C,C经不彻底还原而生成了铁磁性的黑色物D。B溶于稀盐酸生成溶液E,它使KI溶液氧化成I2,但在加入KI前先加入NaF,则KI将不被E所氧化。若向B的浓NaOH悬浮液中通入氯气时可得到一红色溶液F,加入BaCl2时就会沉淀出红棕色固体G,G是一种强氧化剂。试确认A至G所代表的物质。
考题
根据标准电极电位,氧化还原反应MnO2+2Cl-+4H+==Mn2++Cl2+2H2O中,MnO2不能氧化Cl-,但用浓盐酸与MnO2作用,可以生成Cl2。下列哪一种解释最不合理:()A、两个电对的标准电极电位相差不大;B、酸度增加,E°(MnO2/Mn2+)增加;C、[Cl-]增加,E°(Cl2/Cl-)减小;D、盐酸浓度增加,氧化还原反应的速率加大。
考题
单选题K35ClO3晶体和含有H37Cl的浓盐酸反应生成氯气,已知反应方程式为KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,此反应生成氯气的摩尔质量为( ).A
74g·mol-1B
73.3g·mol-1C
72g·mol-1D
70.6g·mol-1
考题
单选题已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量 ②1molCl2分子中化学键断裂时需要吸收243kJ的能量 ③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量。 下列叙述正确的是()。A
氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)2HCl(g)B
氢气和氯气反应生成2mol氯化氢气体,反应的ΔH=+183kJ·mol-lC
氢气和氯气反应生成2mol氯化氢气体,反应的ΔH=-183kJ·mol-lD
氢气和氯气反应生成1mol氯化氢气体,反应的AH=+183kJ·mol-l
考题
单选题已知,从标准电极电势看,MnO2不能氧化Cl-,但用MnO2加浓盐酸,可以生成Cl2,这是因为()。A
两个相差不大B
酸性增强,也增加C
Cl-浓度增加,减少D
以上三个因素都有
热门标签
最新试卷