网友您好, 请在下方输入框内输入要搜索的题目:
(3)上述实验中所用到的氢氧化钠溶液,是小明同学利用实验室中已有的80g溶质质量分数为30%的氢氧化钠溶液现配制的,试计算需加入多少克水,才能配成实验中所需溶质质量分数的氢氧化钠溶液?
70g
在20℃时,把甲、乙各10g固体分别加入到两个盛有50g水的烧杯中,充分搅拌,所得甲溶液为24溶液(填饱和或不饱和);若将温度都升高到30℃,甲溶液中溶质的质量分数25 乙溶液中溶质的质量分数(填大于、等于或小于)。
24:不饱和; 25:等于
配制该溶液的操作步骤
①计算:▲
②称量:用托盘天平称取所需固体,再用▲mL的量筒量取所需的水;
③溶解:将称得的氯化钾固体放入烧杯中,再倒入量取的水,用玻璃棒充分搅拌;
④装瓶:将配制的溶液倒入试剂瓶,并贴上标签。
50
(2)配制一定溶质质量分数的硝酸钾溶液用___________。
ab
A.烧杯、玻璃棒、量筒、容量瓶
B.烧杯、漏斗、容量瓶、移液管
C.烧杯、玻璃棒、容量瓶、胶头滴管
D.烧杯、玻璃棒、容量瓶、滴定管
沪教版初中化学九年级上册第一学期第17周周考试卷一、选择题1实验室配制50g溶质质量分数为6%的NaCl溶液的操作步骤有:计算、称量、量取、溶解该实验过程中不需要用到的仪器是()A玻璃棒 B烧杯 C漏斗 D量筒2实验室配制50g质量分数为6%的氯化钠溶液,整个配制过程如图所示,其正确的操作顺序是()ABCD3实验室配制50g溶质质量分数为15%的氯化钠溶液下列说法中错误的是()A实验的步骤为计算、称取、量取、溶解、转移B溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率C把配制好的氯化钠溶液倒入刚用蒸馏水洗过的试剂瓶中,并贴上标签D量取水时,用规格为50mL的量筒量取42.5mL蒸馏水4要配制100g 5%的NaCl溶液,除了需要托盘天平和量筒外,还需要用到的一组仪器是()A烧杯、试管、玻璃棒 B烧杯、胶头滴管、玻璃棒C烧杯、胶头滴管、漏斗D烧杯、酒精灯、玻璃棒5要配制100g5%的蔗糖溶液,以下操作会导致所配溶液的浓度偏低的是()A称取5g含杂质的蔗糖 B用量筒量取90mL水C搅拌后玻璃棒上有液体残留 D量筒中的水未完全倒入烧杯中6(2015龙岩)下列是小明“配制50g溶质质量分数为20%的氯化钠溶液”的实验过程正确的是()A计算需要氯化钠10g、水40gB将氯化钠放到托盘天平右盘称量C将氯化钠放在量筒中溶解D将配制好的溶液转移一半后,小明认为剩余溶液溶质质量分数为10%7用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是()A玻璃棒 量筒 烧杯 胶头滴管 B托盘天平 量筒 烧杯 玻璃棒C托盘天平 玻璃棒 烧杯 胶头滴管 D量筒 烧杯 漏斗 玻璃棒8(2015成都)通常状况下,下列溶液的溶质为液体的是()A蔗糖溶液B酒精溶液C氯化钠溶液D澄清石灰水9下列说法中正确的是A碘酒是常用的消毒剂,其溶剂是碘 B霉变的花生米洗净后仍可正常食用C可用结晶的方法提纯混有少量氯化钠的硝酸钾D汞、金、钛属于金属元素,硫、氮、铅属于非金属元素10.实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是A.实验的步骤为计算、称取、量取、溶解、转移B.溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率C.把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签D.量取水时,用规格为50mL的量筒量取42.5mL蒸馏水11.实验室用硝酸钾固体配制100.0 g溶质质量分数为3.0%的硝酸钾溶液,下列说法正确的是A. 用50mL量筒量水B. 将固体放于托盘天平的右盘称取C. 将固体直接投人童筒中溶解D. 将配好的溶液装人贴有标签(如图)的试剂瓶中,塞好瓶塞12.为准确配制80g10%的氯化钠溶液,要尽量减小计量仪器称量时的误差。该实验用到了下列仪器,其中属于计量仪器的是( )A. B. C. D. 题号123456789101112答案二、综合题13某同学配制质量分数为5%的氯化钠溶液100g,以备实验(1)通过计算,需称取氯化钠的质量为g(2)配制该溶液所需要的玻璃仪器有:烧杯、量筒、胶头滴管和(仪器名称)(3)量取水的体积时,小盘同学仰视读数,则配制的氯化钠溶液的质量分数将(填“偏小”、“不变”或“偏大”) 14在实验室里可用以下两种方法配制质量分数为10%的NaOH溶液(1)方法一中配制100g 10%的NaOH溶液,需要NaOH固体 g(2)方法二中用量筒量取25%的NaOH溶液时仰视读数,其他操作均正确,所配溶液中溶质的质量分数 10%(选填“大于”、“小于”或“等于”);(3)方法一中的“溶解”和方法二中的“混匀”,都要用到的仪器是 15.(1)已知:水的密度为1.0g/mL。实验室配制50g溶质质量分数为5%的氯化钠溶液,需要称取氯化钠2.5g,需要量取水 。 (2)配制的操作示意图如下,该实验的正确操作顺序为 (填字母序号)。 (3)经检测,所配制溶液的溶质质量分数偏小,其原因可能是 (填序号)。 氯化钠固体不纯 称量时,砝码端忘垫质量相同的纸片 量取水时,仰视读数 装瓶时,有少量溶液洒出16某同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:第1次第2次第3次第4次第5次加入稀盐酸的质量/g2020202020生成气体的总质量/g1.12.2m4.44.4试求:(1)m的值为 g(2)12g石灰石样品中碳酸钙的质量等于 g(3)反应完全后最终溶液中氯化钙的质量分数? (写出计算过程,计算结果精确至0.1)17CuSO4溶液对过氧化氢的分解有催化作用取溶质质量分数为8.5%的过氧化氢溶液20g倒入小烧杯中,向其中加入溶质质量为0.75g 的CuSO4溶液10.8g,使过氧化氢完全分解试计算:(1)产生氧气的质量;(2)反应后所得溶液中CuSO4的质量分数18.实验室用浓盐酸(溶质质量分数为37,密度为1.18g/ml)配制110g溶质质量分数为10的稀盐酸:(1)计算:需要浓盐酸 ml,水 ml。(2)量取:用规格为 ml的量筒(从50ml、100ml中选择)量取浓盐酸,倒入烧杯中,再用规格为 ml的量筒(从50ml、100ml中选择)量取水。(3)稀释: 。19.写出下列反应的化学方程式:(1)镁与稀硫酸反应:(2)铝与稀硫酸反应:(3)锌与稀硫酸反应:(4)铁与稀硫酸反应:(5)镁与稀盐酸反应:(6)铝与稀盐酸反应:(7)锌与稀盐酸反应:(8)铁与稀盐酸反应:(9)a:加热高锰酸钾:b:过氧化氢分解:c:加热氯酸钾:(10) 实验室制取二氧化碳:(11) 检验二氧化碳(与石灰水反应):(12) 一氧化碳还原三氧化二铁(炼铁原理):(13) 一氧化碳还原四氧化三铁:(14) 铁、磷、硫、碳、一氧化碳燃烧:a: b:c: d:4
(10分)⑴利用如图所示装置可测定空气中氧气的含量。
①实验现象,红色物质逐渐变成 。
②反应的化学方程式为 。
③停止加热冷却至室温,注射器内气体的体积大约减少了 。
④实验结论 。
⑵50g溶质质量分数为7.3%的稀盐酸与50g一定溶质质量分数的氢氧化钠溶液恰好完全反应,求反应后所得溶液溶质质量分数。
14、(10分)⑴
①黑色 ②2 Cu+ O2 ==() 2CuO
③约1/5
④空气中氧气的体积分数大约为1/5
⑵解:设生成的氯化钠的质量为x
HCl+NaOH=NaCl+H2O
36.5 58.5
50g×7.3% x
x=5.85g
所得氯化钠溶液中氯化钠的质量分数为:5.85%
答:略
用固体氯化钠配制100g10%的氯化钠溶液,不需要使用的仪器是
A.玻璃棒
B.石棉网
C.烧杯
D.量筒
B.托盘天平、胶头滴管
C.容量瓶
D.分液漏斗
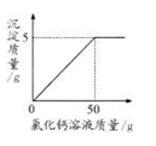
(1)计算样品中NaOH的质量;
(2)计算所加CaCl2溶液的溶质质量分数;
(3)恰好完全反应时烧杯中溶液的pH______7(选填“>”、“<”或“=”)
Na2C03+CaCl2=CaC03↓ +2NaCl
106 111 100
x Y 5 g
106/100=x/5g
x=5.3 g
该样品中NaOH的质量为l0 g-5.3 g=4.7 g
(2)111/y=100/5g
y= 5.55 g
所加CaCl2溶液的溶质质量分数=5.55g/50g×l00%=11.1%
答:样品中NaOH的质量为4.7 g,所加CaCl2溶液的溶质质量分数为ll.1%
(3) >
一、考题回顾


二、考题解析
【教学过程】
(一)谈话导入
【教师提问】上节课我们了解了溶液、溶质、溶剂等这些概念,老师这里有一杯盐水,谁能来给老师说一下盐水中的溶质、溶剂分别是什么?
【学生回答】盐水中,氯化钠是溶质,水是溶剂,盐水为溶液
【教师总结】那如果老师告诉大家这杯盐水中氯化钠的质量分数是10%,总质量是80g的话,如何准确的配制这样一杯溶液呢?
(二)新课教学
1.实验前准备
【教师提问】如果想要配制一定质量分数的溶液,大家猜想一下,我们需要准备哪些实验用品以及实验器材呢?
【学生回答】需要托盘天平称取溶质的质量
【学生回答】玻璃棒进行搅拌,烧杯进行盛装液体。
【学生回答】药品氯化钠、蒸馏水
【教师总结】大家总结的都很好,需要准备的实验器材包括,托盘天平(或电子秤)、烧杯、玻璃棒、氯化钠以及蒸馏水,量筒、钥匙。
【教师提问】同学们,在使用之前,先回顾一下托盘天平的使用步骤
【学生回答】(1)左物右砝;(2)使用前调节平衡,调节游码、指针都归零;(3)取用砝码用镊子;(4)物品不能直接放在托盘上称量,需要放在纸上或者烧杯中;(5)称量完毕将砝码放入盒内,将游码归零。
2.动手实验
【教师提问】在做实验之前我们应该做哪些准备?
【学生回答】需要先计算出所要称取的氯化钠的质量,也就是80g×10%=8g
【教师引导】现在同学们可以以实验小组为单位,来设计一下配制80g 10%氯化钠溶液的流程及步骤
【学生回答】(1)取氯化钠药品(计算);(2)称量;(3)溶解
【教师引导】那同学们根据你们设计的实验方案开始动手做实验,在实验的过程中注意实验操作的规范性以及小组之间的合作分配。
【教师提问】同学们说一下在量取蒸馏水以及搅拌中注意的事项?
【学生回答】本次实验所需蒸馏水是72mL,先用100mL量筒量取70mL蒸馏水,其次再用10mL量取2mL蒸馏水,在量取中要注意将量筒放平,视线与刻度线保持水平;搅拌过程中要边加水边搅拌,而且搅拌时候尽量不要使玻璃棒触碰容器的器壁。
【教师总结】同学们在刚刚的实验中操作都很规范。在配制一定质量分数的溶液的实验中,第一步是计算溶质、溶剂的质量;第二步是称量药品;第三步是加水搅拌溶解。
(三)巩固提高
【教师提问】
(1)称量时,药品和砝码放反了,但是没有使用游码,对结果的影响是什么?
(2)玻璃棒的作用是什么?
(3)在量取溶剂时,俯视量筒,造成结果偏大还是偏小?
(四)小结作业
小结:学生总结本节课重点知识,教师补充。
作业:与同学间交流本次实验的经验和教训。
【板书设计】

【答辩题目解析】
1.如果在实验操作中,在称量药品过程中,发现垫纸以后,天平指针向左偏,结果会怎样?
2.将量筒中的水倒入烧杯时,烧杯中有少量水残余,实验结果会怎样?
只在称量食盐的托盘垫上了干净的纸,导致称量的食盐质量偏低,溶质质量分数偏低。
2.
将量筒中的水倒入烧杯时,因为量筒中有少量水残余,使所配氯化钠溶液中的水减少了,质量分数变大了。
更多 “沪教版初中化学九年级上册第一学期第17周周考试卷” 相关考题
- 2020年以中国为主要贸易伙伴的国家,已经超过百分之多少
- 空降兵不属于什么军种? A.海军 B.陆军 C.火箭军 D.空军
- 论持久战一书发表于多少年。
- 行为主义学派强调( )因素对人格与行为的作用。A.环境B.基因C.认知D.本能
- 贷款业务是商业银行的主要资产业务之一,也是银行资金运用的主要形式。
- 借贷记账法的主要内容是什么?
- ( 难度:中等)下列叙述中,错误的是()。A.线性链表中的各元素在存储空间中的位置必须是连续的 B.线性链表中的表头元素一定存储在其他元素的前面C.线性链表中的各元素在存储空间中的位置不一定是连续的,但表头元素一定存储在其他元素的前面D.线性链表中的各元素在存储空间中的位置不一定是连续的,且各元素的存储顺序也是任意的
- ( 难度:中等)下列关于Hadoop API的说法正确的是A.Hadoop的文件API不是通用的,只用于HDFS文件系统B.Configuration类的默认实例化方法是以HDFS系统的资源配置为基础的C.FileStatus对象存储文件和目录的元数据D.FSDataInputStream是javio.DataInputStream的子类
- 下面观点哪个更符合社会学习理论的人格观( )。A.人格是受个人本能驱动的B.人格是人与环境相互作用的结果C.人格是外显与内隐反应的总和,这些反应是个人被强化后的结果D.人格是外在环境塑造的产物
- 固定资产、无形资产、长期待摊费用等物权形式存在的资产不属于金融资产。