网友您好, 请在下方输入框内输入要搜索的题目:
题目内容
(请给出正确答案)
将6 mL 0.2 mol/L盐酸与10 mL 0.1 mol/L氨水混合,完全反应后,溶液中各种离子浓度的相对大小是.
参考答案
参考解析
解析: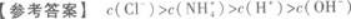 【解题指要】(1)首先要强调,将两种溶液混合时必须考虑这一过程中是否发生化学反应.如本题是将盐酸与氨水混合,会发生化学反应:
【解题指要】(1)首先要强调,将两种溶液混合时必须考虑这一过程中是否发生化学反应.如本题是将盐酸与氨水混合,会发生化学反应:

根据HCl和NH3的数量的不同.可能有三种情况:
①恰好完全反应,此时就变成NH4Cl溶液;
②HCl有剩余,此时就是NH4Cl和HCl的混合溶液;
③NH3有剩余,此时就是NH4Cl与NH3的混合溶液.
(2)盐酸中HCl的物质的量为:0.2 mol/L×0.006 L=0.001 2 mol.
氨水中NH3的物质的量为:0.1 mol/L×0.01 L=0.001 mol.
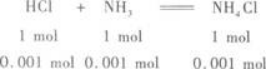
所以,反应后生成NH4Cl 0.001 mol,剩余的HCl为0.001 2 mol-0.001 mol=0.000 2 mol.
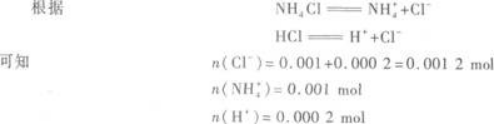
以上物质的量的大小顺序就是离子浓度的大小顺序.
另外,一般情况下,溶液均指水溶液,所以溶液中还有水电离出来的H+和OH-两种离子
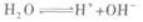
此题中酸有剩余,所以c(H+)一定大于c(OH-).

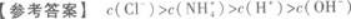 【解题指要】(1)首先要强调,将两种溶液混合时必须考虑这一过程中是否发生化学反应.如本题是将盐酸与氨水混合,会发生化学反应:
【解题指要】(1)首先要强调,将两种溶液混合时必须考虑这一过程中是否发生化学反应.如本题是将盐酸与氨水混合,会发生化学反应:

根据HCl和NH3的数量的不同.可能有三种情况:
①恰好完全反应,此时就变成NH4Cl溶液;
②HCl有剩余,此时就是NH4Cl和HCl的混合溶液;
③NH3有剩余,此时就是NH4Cl与NH3的混合溶液.
(2)盐酸中HCl的物质的量为:0.2 mol/L×0.006 L=0.001 2 mol.
氨水中NH3的物质的量为:0.1 mol/L×0.01 L=0.001 mol.
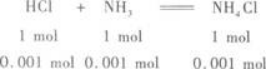
所以,反应后生成NH4Cl 0.001 mol,剩余的HCl为0.001 2 mol-0.001 mol=0.000 2 mol.
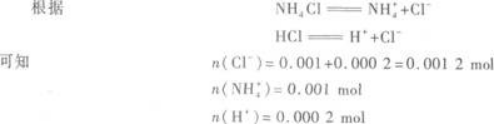
以上物质的量的大小顺序就是离子浓度的大小顺序.
另外,一般情况下,溶液均指水溶液,所以溶液中还有水电离出来的H+和OH-两种离子
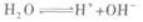
此题中酸有剩余,所以c(H+)一定大于c(OH-).

更多 “将6 mL 0.2 mol/L盐酸与10 mL 0.1 mol/L氨水混合,完全反应后,溶液中各种离子浓度的相对大小是.” 相关考题
考题
将1L4mol/L氨水和1L2mol/L盐酸溶液混合,混合后OH-矿离子浓度为:
A. 1mol/L
B. 2mol/L
C. 8.0X10-6mol/L
D. 1. 8X 10-5mol/L
考题
下列溶液混合,属于缓冲溶液的是:
A. 50mL0.2mol?L-1CH3COOH与50mL0.1mol?L-1NaOH
B. 50mL0.1mol?L-1CH3COOH与50mL0.1mol?L-1NaOH
C. 50mL0.1mol?L-1CH3COOH与50mL0.2mol?L-1NaOH
D. 50mL0.2mol?L-1HCl与50mL0. 1mol?L-1NH3H2O
考题
将1L4mol/L氨水和1L2mol/L盐酸溶液混合,混合后OH-矿离子浓度为:
A. 1mol/L B. 2mol/L
C. 8.0X10-6mol/L D. 1. 8X 10-5mol/L
考题
下列溶液混合,属于缓冲溶液的是( )。
A. 50ml0.2mol/L-1CH3COOH 和 50ml 0.1 mol/L-1 NaOH 混合
B. 50ml0.1 mol/L-1CH3COOH 和 50ml 0.1 mol/L-1 NaOH 混合
C. 50ml0. ImoiyL-1 CH3COOH 和 50ml 0.2 mol/L-1 NaOH 混合
D. 50ml0.2mol/L-1 HCl 和 50ml 0.1 mol/L-1 NH3H2O混合
考题
50ml0.2mol/LAlCl3和50ml0.1mol/LCaCl2溶液相混合后,Cl-的浓度是()A、0.5mol/LB、0.4mol/LC、0.3mol/LD、0.2mol/LE、0.1mol/L
考题
下列混合溶液是否具有缓冲作用?为什么? (1)0.1mol·L-1的KH2PO4溶液50ml与0.1 mol·L-1Na2HPO4溶液50ml混合。 (2)0.2mol·L-1的HAc溶液50ml与0.2 mol·L-1的NaOH溶液25ml混合。 (3)0.1mol·L-1的NH3·H2O溶液50ml与0.2 mol·L-1的HCl溶液25ml混合。 (4)0.1mol·L-1的HCl溶液50ml与0.1 mol·L-1的KCl溶液10ml混合。 (5)1×10-3mol·L-1的HAc溶液50ml与1×10-3mol·L-1的NaAc溶液50ml混合。
考题
与0.2mol/L的HCl溶液100mL,氢离子浓度相同的溶液是()。A、0.2mol/l的H2SO4溶液50mLB、0.1mol/L的HNO3溶液200mLC、0.4mol/l的醋酸溶液100mLD、0.1mol/L的H2SO4溶液100mL
考题
NA为阿伏加德罗常数,下列关于0.2mol/LK2SO4溶液的正确说法是()A、500mL溶液中所含K+、SO42-总数为0.3NAB、500mL溶液中含有0.1NA个K+离子C、1L溶液中K+离子浓度是0.2mol/LD、2L溶液中SO42-离子浓度是0.4mol/L
考题
在30ml 1mol/L氯化钠溶液和40ml 1mol/L氯化钙溶液混合后,混合溶液中氯离子摩尔浓度为()。A、0.5mol/LB、1.0mol/LC、0.67mol/LD、2.0mol/L
考题
将1L4mol·L-1氨水与1L2mol·L-1盐酸溶液混合,混合后OH-离子浓度为().A、1mol·L-1B、2mol·L-1C、8.0×10-5mol·L-1D、1.8×10-5mol·L-1
考题
单选题下列溶液中含Cl一浓度最大的是( ).A
10mL0.1mol/L的AlCl3溶液B
20mL0.1mol/L的CaCl2溶液C
30mL0.2mol/L的KCl溶液D
100mL0.25mol/L的NaCl溶液
考题
单选题40mL0.1mol/L KNO3溶液和60mL0.2mol/L K2SO4溶液混合,若混合时溶液体积的微小变化忽略不计,则混合溶液中K+的物质的量浓度为( ).A
0.3mol/LB
0.24mol/LC
0.28mol/LD
0.16mol/L
考题
单选题向200mL0.1mol/L Na2SO4溶液中加入100mL0.25mol/L的Ba(OH)2溶液后,还需加入多少盐酸才能恰好完全中和( ).A
10mL lmol/L盐酸B
5mL lmol/L盐酸C
50mL lmol/L盐酸D
25mL 0.5mol/L盐酸
考题
单选题将5mL10mol/L盐酸稀释为250mL溶液,再从稀释后的溶液中取出10mL溶液的摩尔浓度是().A
0.08mol/LB
0.2mol/LC
0.5mol/LD
1mol/L
考题
单选题下列溶液混合,属于缓冲溶液的是( )。[2011年真题]A
50mL 0.2mol·L-1CH3COOH与50mL 0.1mol·L-1NaOHB
50mL 0.1mol·L-1CH3COOH与50mL 0.1mol·L-1NaOHC
50mL 0.1mol·L-1CH3COOH与50mL 0.2mol·L-1NaOHD
50mL 0.2mol·L-1HCl与50mL 0.1mol·L-1NH3·H2O
考题
判断题将100mL0.1mol·L-1HAc溶液加到100mL0.1mol·L-1NaOH溶液中,因恰能中和完全,所以混合溶液应显中性。A
对B
错
热门标签
最新试卷