网友您好, 请在下方输入框内输入要搜索的题目:
题目内容
(请给出正确答案)
在以下反应中,增大系统的压力时平衡不发生转移的反应是()。
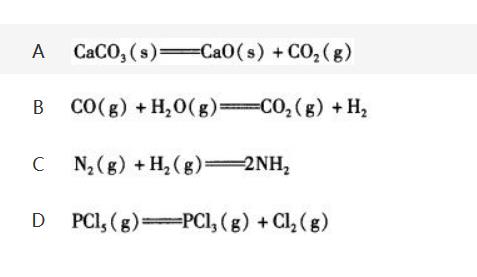
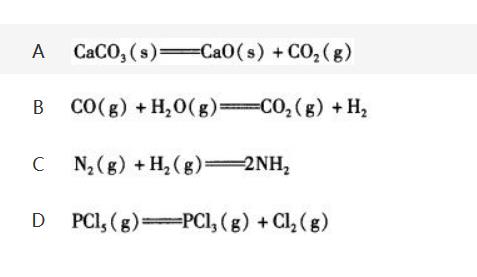
参考答案
参考解析
解析:
更多 “在以下反应中,增大系统的压力时平衡不发生转移的反应是()。 ” 相关考题
考题
在温度TK下,反应CaCO3(s)=CaO(s)+CO2(g)的平衡系统的压力为p,若往该平衡系统加入CO2(g),当重新达到平衡时,系统的压力______。A、变大B、变小C、不变D、可能变大或变小
考题
在容器不变的密闭容器中,在一定条件下发生反应:2A(g)=B(g)+C(S),且达到化学平衡,当升高温度时其容器内气体的密度增大,则下列判断正确的是()A、若正反应是吸热反应,则A为非气态B、若正反应是放热反应,则A为气态C、若在平衡体系中加入少量C该平衡向逆反应方向移动D、压强对该平衡的移动无影响
考题
在平衡体系中,增温则平衡常数K变小,则下列选项正确的是()。A、正反应是放热反应,逆反应是吸热反应B、正逆反应都是吸热反应C、正逆反应都是放热反应D、正反应是吸热反应,逆反应是放热反应
考题
在A+B=C+D平衡体系中,增温则平衡常数K变小,则下列选项正确的是()。A、正反应是放热反应,逆反应是吸热反应B、正逆反应都是吸热反应C、正逆反应都是放热反应D、正反应是吸热反应,逆反应是放热反应
考题
影响化学平衡的因素有哪些?()A、浓度:当反应达到平衡时,增加反应物浓度则平衡被破坏,平衡向右移动,反应向正方向进行,反之,若增加生成物浓度时,则平衡向左移动,反应向逆方向进行。B、压力:对于气体反应,当增高压力时,平衡则向体积增大的方向移动。压力对固体或液体的体积变化影响很小,压力改变时,只考虑反应前后气态物质的分子数有无变化。C、温度:在平衡体系中,温度升高,平衡向放热方向移动;反之,温度降低,则平衡向吸热方向移动。D、温度:在平衡体系中,温度升高,平衡向吸热方向移动;反之,温度降低,则平衡向放热方向移动。
考题
已知反应CO(g)+2H2(g)↔CH3OH(g)的KΘ(523K)=2.33×10-3,KΘ(548K)=5.42×10-4,则该反应是放热反应。当平衡后将系统容积压缩增大压力时,平衡向()反应方向移动;加入催化剂后平衡将()。
考题
已知反应的,下列叙述正确的是()。A、由于,随着反应的进行,PC逐渐增大,pA、pB逐渐减小,平衡常数逐渐增大B、升高温度,使增大,减小,将导致平衡向左移动C、加入催化剂,同等程度加快正、逆反应的速率,加速达到平衡D、增加压力,使pA、pB增大,增大,而平衡左移
考题
设反应aA+bB=gG+hH,在p下,300K时的转化率是600K的2倍,在300K下,总压力为p时的转化率是总压力2p的2倍,可推测该反应:()A、平衡常数与温度、压力成正比B、平衡常数与温度成正比,与压力成反比C、该反应是一个体积增加的放热反应D、该反应是一个体积增加的吸热反应
考题
N2(g)+3H2(g)=2NH3(g)反应,是()反应(放热,吸热,不放热也不吸热);温度升高反应的平衡常数K0()(增大,减小,不变),平衡时NH3(g)的摩尔分数()(增大,减小,不变),在恒T,P下反应系统中惰性气体如Ar,CH4等的含量增加,则平衡时N2的转化率()(增大,减小,不变),若原料的配比远离nH2:nN2=3:1之值,则平衡时NH3(g)的含量();若升高压力,平衡时的NH3(g)含量()。
热门标签
最新试卷
